الفرق بين المراجعتين لصفحة: «حمض الجاوي»
لا ملخص تعديل |
كنان الطرح (نقاش | مساهمات) لا ملخص تعديل |
||
| سطر 1: | سطر 1: | ||
'''حمض الجاوي Benzoic Acid''' هو [[بلورة|بلورات]] بيضاء، حرشفية أو إبرية، له رائحة مميزة خفيفة. | '''حمض الجاوي Benzoic Acid''' هو [[بلورة|بلورات]] بيضاء، حرشفية أو إبرية، له رائحة مميزة خفيفة. | ||
[[ملف:Benzoic acid.jpg|تصغير|حمض البنزوئيك]] | [[ملف:Benzoic acid.jpg|تصغير|حمض البنزوئيك]] | ||
==لمحة تاريخية== | |||
اُكتشف حمض البنزوئيك في القرن السادس عشر، وذلك بعد عملية التقطير الجاف لصمع البنزوئين، وصف هذه العملية لأول مرة العالِم (نوستراداموس) في عام 1556، ومن ثم وصفها بعده العالمان (أليكسيوس بيديمونتانوس) في عام 156، و(باليس دو فيانير) في عام 1596. | |||
==تعريف== | |||
*حمض البنزوئيك (Benzoic acid)، هو عبارة عن حمض كربوكسيلي عطري بسيط، يكون بشكل صلب بلّوري شفّاف (عديم اللون). | |||
*اسم الحمض مشتق من صمغ البنزوئين (Gum benzoin)، الذي كان المصدر الوحيد المعروف لحمض البنزوئيك لفترة طويلة. | |||
*يتواجد حمض البنزوئيك بصورة طبيعية في العديد من النباتات، كما يلعب الحمض دور الوسيط في تفاعلات اصطناع العديد من المُستقلبات الثانويّة. | |||
*تُستخدم أملاح حمض البنزوئيك كمواد مُضافة إلى الطعام، كذلك يُعدّ حمض البنزوئيك طليعة هامة لبدء تفاعلات اصطناع العديد من المركبات الكيميائية العضويّة. | |||
*أملاح وإسترات حمض البنزوئيك تُعرف باسم: بنزوات Benzoates. | |||
==الانحلالية Solubility== | ==الانحلالية Solubility== | ||
*ضعيف الانحلال في ال[[ماء]]، وينحل في الماء الغالي. | |||
*سهل الانحلال في ال[[كحول]]. | |||
*يتطاير في ال[[بخار]]. | |||
==الإنتاج== | |||
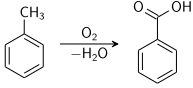
===التحضير الصناعي (التجاريّ)=== | |||
يُحضر حمض البنزوئيك تجارياً بالأكسدة الجزئية لمركب التولوين (Toluene) باستخدام الأوكسجين، ويُستخدم مركب الكوبالت (Cobalt) أو مركب نفتولات المنغنيز (Manganese naphthenates) كمحفز في هذه العملية. | |||
تنطلق هذه العملية من مواد أولية متوفرة، وتعطي مردوداً بنسب عالية. | |||
[[ملف:Benzoic.png|تصغير]] | |||
===الاصطناع في المختبر=== | |||
إن مركب حمض البنزوئيك رخيص ومتوفر، لذلك يمكن القول إن الهدف الرئيسي من اصطناعه في المختبرات هو أهمية هذا المركب في القطاع التعليمي، حيث أنه مادة شائعة في التجارب الجامعية. | |||
يمكن تنقية حمض البنزوئيك من الماء باستخدام عملية إعادة التبلور (recrystallization)، حيث أن حمض البنزوئيك شديد الانحلالية في الماء الحار، وقليل الانحلالية في الماء البارد. | |||
===الاصطناع بعملية الإرجاع=== | |||
كما هو الحال في النتريلات والأميدات، يمكن إرجاع مركب البنزونتريل (Benzonitrile) والبنزاميد (Benzamide) لتشكيل حمض البنزوئيك. | |||
===انطلاقاً من مركب البنزألدهيد=== | |||
نستطيع أيضاً الحصول على حمض البنزوئيك بالانطلاق من مركب البنزألدهيد (Benzaldehyde)، أو من مركب البروموبنزن (Bromobenzene)، أو من مركب بنزيل الكحول (Benzyl alcohol)، أو من مركب كلورايد البنزيل (Benzyl chloride). | |||
==الاستعمالUse== | ==الاستعمالUse== | ||
[[مادة حافظة]] ميكروبية Antimicrobial Preservative. | [[مادة حافظة]] ميكروبية Antimicrobial Preservative. | ||
يستخدم حمض البنزوئيك بشكل أساسي في اصطناع الفينول بعملية نزع الكربوكسيل التأكسدية (oxidative decarboxylation)، بدرجة حرارة 300-400 °C: | |||
C6H5CO2H + 1/2 O2 → C6H5OH + CO2 | |||
==الحفظ والتخزين packaging &Storage== | ==الحفظ والتخزين packaging &Storage== | ||
يحفظ في عبوات محكمة الإغلاق. | يحفظ في عبوات محكمة الإغلاق. | ||
==المصدر== | |||
دستور الأدوية الأمريكي الـ USP | |||
https://en.wikipedia.org/wiki/Benzoic_acid | |||
{{أدوية مضادة للمفصليات كالجرب والقمل}} | |||
[[تصنيف:أدوية]] | |||
[[تصنيف:موسوعة الأدوية]] | |||
[[تصنيف:صيدلة]] | [[تصنيف:صيدلة]] | ||
[[تصنيف: مواد حافظة]] | [[تصنيف: مواد حافظة]] | ||
[[تنصنيف:سواغات]] | |||
[[تصنيف:أدوية مضادة للمفصليات كالجرب والقمل]] | |||
مراجعة 09:03، 12 أبريل 2018
حمض الجاوي Benzoic Acid هو بلورات بيضاء، حرشفية أو إبرية، له رائحة مميزة خفيفة.
لمحة تاريخية
اُكتشف حمض البنزوئيك في القرن السادس عشر، وذلك بعد عملية التقطير الجاف لصمع البنزوئين، وصف هذه العملية لأول مرة العالِم (نوستراداموس) في عام 1556، ومن ثم وصفها بعده العالمان (أليكسيوس بيديمونتانوس) في عام 156، و(باليس دو فيانير) في عام 1596.
تعريف
- حمض البنزوئيك (Benzoic acid)، هو عبارة عن حمض كربوكسيلي عطري بسيط، يكون بشكل صلب بلّوري شفّاف (عديم اللون).
- اسم الحمض مشتق من صمغ البنزوئين (Gum benzoin)، الذي كان المصدر الوحيد المعروف لحمض البنزوئيك لفترة طويلة.
- يتواجد حمض البنزوئيك بصورة طبيعية في العديد من النباتات، كما يلعب الحمض دور الوسيط في تفاعلات اصطناع العديد من المُستقلبات الثانويّة.
- تُستخدم أملاح حمض البنزوئيك كمواد مُضافة إلى الطعام، كذلك يُعدّ حمض البنزوئيك طليعة هامة لبدء تفاعلات اصطناع العديد من المركبات الكيميائية العضويّة.
- أملاح وإسترات حمض البنزوئيك تُعرف باسم: بنزوات Benzoates.
الانحلالية Solubility
الإنتاج
التحضير الصناعي (التجاريّ)
يُحضر حمض البنزوئيك تجارياً بالأكسدة الجزئية لمركب التولوين (Toluene) باستخدام الأوكسجين، ويُستخدم مركب الكوبالت (Cobalt) أو مركب نفتولات المنغنيز (Manganese naphthenates) كمحفز في هذه العملية. تنطلق هذه العملية من مواد أولية متوفرة، وتعطي مردوداً بنسب عالية.
الاصطناع في المختبر
إن مركب حمض البنزوئيك رخيص ومتوفر، لذلك يمكن القول إن الهدف الرئيسي من اصطناعه في المختبرات هو أهمية هذا المركب في القطاع التعليمي، حيث أنه مادة شائعة في التجارب الجامعية.
يمكن تنقية حمض البنزوئيك من الماء باستخدام عملية إعادة التبلور (recrystallization)، حيث أن حمض البنزوئيك شديد الانحلالية في الماء الحار، وقليل الانحلالية في الماء البارد.
الاصطناع بعملية الإرجاع
كما هو الحال في النتريلات والأميدات، يمكن إرجاع مركب البنزونتريل (Benzonitrile) والبنزاميد (Benzamide) لتشكيل حمض البنزوئيك.
انطلاقاً من مركب البنزألدهيد
نستطيع أيضاً الحصول على حمض البنزوئيك بالانطلاق من مركب البنزألدهيد (Benzaldehyde)، أو من مركب البروموبنزن (Bromobenzene)، أو من مركب بنزيل الكحول (Benzyl alcohol)، أو من مركب كلورايد البنزيل (Benzyl chloride).
الاستعمالUse
مادة حافظة ميكروبية Antimicrobial Preservative.
يستخدم حمض البنزوئيك بشكل أساسي في اصطناع الفينول بعملية نزع الكربوكسيل التأكسدية (oxidative decarboxylation)، بدرجة حرارة 300-400 °C:
C6H5CO2H + 1/2 O2 → C6H5OH + CO2
الحفظ والتخزين packaging &Storage
يحفظ في عبوات محكمة الإغلاق.
المصدر
دستور الأدوية الأمريكي الـ USP