الفرق بين المراجعتين لصفحة: «نقطة ثلاثية»
ط (١ مراجعة: فيزياء) |
ط (مراجعة واحدة) |
||
| (مراجعة متوسطة واحدة بواسطة نفس المستخدم غير معروضة) | |||
| سطر 1: | سطر 1: | ||
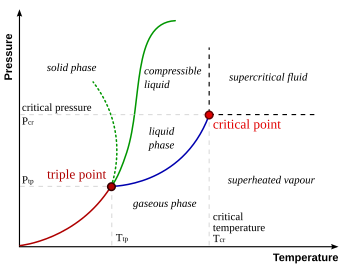
[[ملف:Phase-diag.svg| 350px| left| thumb|مخطط أطوار المادة، تظهر فيه النقطة الثلاثية ( Triple point) ، والنقطة الحرجة (critical point ). ]] | [[ملف:Phase-diag.svg|350px| left| thumb|مخطط أطوار المادة، تظهر فيه النقطة الثلاثية (Triple point)، والنقطة الحرجة (critical point).]] | ||
في [[ديناميكا حرارية|الديناميكا الحرارية]] تعني '''النقطة الثلاثية ''' أيضا '''نقطة الحالات الثلاثة ''' للمادة : [[حالة صلبة|الحالة الصلبة]] ، و[[حالة سائلة|الحالة السائلة]] ، و[[حالة غازية|الحالة الغازية]] ، حيث | في [[ديناميكا حرارية|الديناميكا الحرارية]] تعني '''النقطة الثلاثية ''' أيضا '''نقطة الحالات الثلاثة ''' للمادة : [[حالة صلبة|الحالة الصلبة]]، و[[حالة سائلة|الحالة السائلة]]، و[[حالة غازية|الحالة الغازية]]، حيث تتوحد تلك الحالات الثلاث عند نقطة معينة من [[درجة حرارة|درجة الحرارة]] و[[ضغط|الضغط]]، مع ثبوت [[حجم|الحجم]]، وتكون تلك الحالات للمادة في حالة اتزان عند تلك النقطة. وتتميز كل مادة بنقطتها الثلاثية الخاصة بها طبقا لخواصها الطبيعية والكيميائية. | ||
وهذا يعني أنه بالنسبة | وهذا يعني أنه بالنسبة للماء، يتواجد [[ماء|الماء]] و[[بخار|البخار]] و[[ثلج|الثلج]] جميعا عند النقطة الثلاثية بدون أن تتغير نسبة تواجدهم. ويحدث ان بتبخر الثلج مباشرة إلى بخار بدون أن يتحول أولا إلى ماء ثم إلى بخار، وذلك ما يُعرف [[تسامي|بالتسامي]]، كما يمكن عند تلك النقطة تحول [[سائل|السائل]] إلى [[بخار]]، والثلج إلى ماء. كما يمكن للثلاثة عمليات العكسية أن تحدث في نفس الوقت، وهذا ما يعني أن الثلاثة حالات توجد في حالة اتزان. أي يمكن للماء في نفس الوقت أن يتحول إلى ثلج، والبخار إلى ثلج وماء. والمهم هنا أن الكمية من كل حالة تظل ثابتة لا تتغير. أما عند خفض درجة الحرارة عن تلك الدرجة أو رفع الضغط عن تلك النقطة الثلاثية فتظل الثلاثة حالات موجودة مع تغير نسبها. وبحسب تغييرنا لتلك الظروف من درجة حرارة وتغيير للضغط، تبدأ إحدى الحالات في الاختفاء ويتبقى حالتين اثنتين في حالة إتزان. فمثلا عند رفع درجة الحرارة ورفع الضغط عن النقطة الثلاثية، تبدأ مرحلة اختفاء الثلج ويصبح الماء والبخار في حالة التوازن، وهذا طبقا لمسار الخط الأزرق في الشكل :[[مخطط الطور]]. | ||
== النقطة الثلاثية للماء == | == النقطة الثلاثية للماء == | ||
اتفق عالميا عام في عام 1976 على اعتبار النقطة الثلاثية للماء عند ضغط 611,657 [[باسكال]] (يعادل 006و0 [[بار]] أو 006و0 ضغط | اتفق عالميا عام في عام 1976 على اعتبار النقطة الثلاثية للماء عند ضغط 611,657 [[باسكال]] (يعادل 006و0 [[بار]] أو 006و0 ضغط جوي، ودرجة حرارة 273,16 [[كلفن]] (تعادل 0,01 درجة مئوية). | ||
وهي تُتخذ لمعايرة الترمومترات. | |||
== قاعدة جيبس لحالات المادة == | == قاعدة جيبس لحالات المادة == | ||
{{ | {{مقال تفصيلي|طاقة جيبس الحرة}} | ||
وضع [[جيبس]] القاعدة التالية للنقطة الثلاثية ووصف عدد حالات المادة : | وضع [[جيبس]] القاعدة التالية للنقطة الثلاثية ووصف عدد حالات المادة : | ||
| سطر 20: | سطر 19: | ||
حيث: | حيث: | ||
''f'' عدد الإمكانيات للمادة أن تظهر في حالات | ''f'' عدد الإمكانيات للمادة أن تظهر في حالات مختلفة، | ||
عندما تكون N'' = 1 '' لمادة واحدة (نقية) تكون P'' = 3 '' (أي ثلاثة حالات)، ذلك لأنه طبقا للقاعدة ''f'' == 0'' عند النقطة الثلاثية. | |||
وهذا يعني أنه عند تغيير أحد الإحداثيات (درجة الحرارة أو الضغط أو الحجم) عند النقطة الثلاثية، يخرج النظام من حالة الاتزان. وهذا هو تفسير عدم وجود نظام ذو 4 حالات للمادة، يمكن تواجدها جميعا في نقطة واحدة. (يستلزم ذلك أن تكون f'' == −1 ''.) | |||
وهذا يعني أنه عند تغيير أحد الإحداثيات (درجة الحرارة أو الضغط أو الحجم ) عند النقطة | |||
== نقط للمعايرة == | == نقط للمعايرة == | ||
تجعل انفرادية النقطة الثلاثية خاصة هامة لمعايرة [[ترمومتر|الترمومترات]] ، حيث تتخذ عدة نقاط ثلاثية لمواد مواد عالية النقاوة لإجراء المعايرة . من تلك المواد : | تجعل انفرادية النقطة الثلاثية خاصة هامة لمعايرة [[ترمومتر|الترمومترات]]، حيث تتخذ عدة نقاط ثلاثية لمواد مواد عالية النقاوة لإجراء المعايرة. من تلك المواد : | ||
النقطة الثلاثية [[زئبق|للزئبق]] 234,31560 [[كلفن]] (تعادل -38,83440 درجة مئوية وضغط 437,96808 باسكال، | النقطة الثلاثية [[زئبق|للزئبق]] 234,31560 [[كلفن]] (تعادل -38,83440 درجة مئوية وضغط 437,96808 باسكال، | ||
النقطة الثلاثية للماء 273,16000 كلفن (تعادل 0,01000 درجة مئوية ) ، وضغط 611,657 باسكال. | النقطة الثلاثية للماء 273,16000 كلفن (تعادل 0,01000 درجة مئوية)، وضغط 611,657 باسكال. | ||
== أنظر أيضا ً == | == أنظر أيضا ً == | ||
| سطر 42: | سطر 40: | ||
* [[محرار|مقياس درجة الحرارة]] | * [[محرار|مقياس درجة الحرارة]] | ||
[[تصنيف: | [[تصنيف:خصائص كيميائية]] | ||
[[تصنيف:تغيرات الطور]] | |||
[[تصنيف:كيمياء]] | [[تصنيف:كيمياء]] | ||
[[تصنيف:ديناميكا حرارية]] | [[تصنيف:ديناميكا حرارية]] | ||
المراجعة الحالية بتاريخ 14:15، 16 سبتمبر 2013
في الديناميكا الحرارية تعني النقطة الثلاثية أيضا نقطة الحالات الثلاثة للمادة : الحالة الصلبة، والحالة السائلة، والحالة الغازية، حيث تتوحد تلك الحالات الثلاث عند نقطة معينة من درجة الحرارة والضغط، مع ثبوت الحجم، وتكون تلك الحالات للمادة في حالة اتزان عند تلك النقطة. وتتميز كل مادة بنقطتها الثلاثية الخاصة بها طبقا لخواصها الطبيعية والكيميائية.
وهذا يعني أنه بالنسبة للماء، يتواجد الماء والبخار والثلج جميعا عند النقطة الثلاثية بدون أن تتغير نسبة تواجدهم. ويحدث ان بتبخر الثلج مباشرة إلى بخار بدون أن يتحول أولا إلى ماء ثم إلى بخار، وذلك ما يُعرف بالتسامي، كما يمكن عند تلك النقطة تحول السائل إلى بخار، والثلج إلى ماء. كما يمكن للثلاثة عمليات العكسية أن تحدث في نفس الوقت، وهذا ما يعني أن الثلاثة حالات توجد في حالة اتزان. أي يمكن للماء في نفس الوقت أن يتحول إلى ثلج، والبخار إلى ثلج وماء. والمهم هنا أن الكمية من كل حالة تظل ثابتة لا تتغير. أما عند خفض درجة الحرارة عن تلك الدرجة أو رفع الضغط عن تلك النقطة الثلاثية فتظل الثلاثة حالات موجودة مع تغير نسبها. وبحسب تغييرنا لتلك الظروف من درجة حرارة وتغيير للضغط، تبدأ إحدى الحالات في الاختفاء ويتبقى حالتين اثنتين في حالة إتزان. فمثلا عند رفع درجة الحرارة ورفع الضغط عن النقطة الثلاثية، تبدأ مرحلة اختفاء الثلج ويصبح الماء والبخار في حالة التوازن، وهذا طبقا لمسار الخط الأزرق في الشكل :مخطط الطور.
النقطة الثلاثية للماء
اتفق عالميا عام في عام 1976 على اعتبار النقطة الثلاثية للماء عند ضغط 611,657 باسكال (يعادل 006و0 بار أو 006و0 ضغط جوي، ودرجة حرارة 273,16 كلفن (تعادل 0,01 درجة مئوية).
وهي تُتخذ لمعايرة الترمومترات.
قاعدة جيبس لحالات المادة
وضع جيبس القاعدة التالية للنقطة الثلاثية ووصف عدد حالات المادة :
f = N − P + 2
حيث:
f عدد الإمكانيات للمادة أن تظهر في حالات مختلفة، عندما تكون N = 1 لمادة واحدة (نقية) تكون P = 3 (أي ثلاثة حالات)، ذلك لأنه طبقا للقاعدة f == 0 عند النقطة الثلاثية.
وهذا يعني أنه عند تغيير أحد الإحداثيات (درجة الحرارة أو الضغط أو الحجم) عند النقطة الثلاثية، يخرج النظام من حالة الاتزان. وهذا هو تفسير عدم وجود نظام ذو 4 حالات للمادة، يمكن تواجدها جميعا في نقطة واحدة. (يستلزم ذلك أن تكون f == −1 .)
نقط للمعايرة
تجعل انفرادية النقطة الثلاثية خاصة هامة لمعايرة الترمومترات، حيث تتخذ عدة نقاط ثلاثية لمواد مواد عالية النقاوة لإجراء المعايرة. من تلك المواد :
النقطة الثلاثية للزئبق 234,31560 كلفن (تعادل -38,83440 درجة مئوية وضغط 437,96808 باسكال،
النقطة الثلاثية للماء 273,16000 كلفن (تعادل 0,01000 درجة مئوية)، وضغط 611,657 باسكال.