الفرق بين المراجعتين لصفحة: «كيمياء»
Abdullah-Safi (نقاش | مساهمات) (أنشأ الصفحة ب'تصغير|يسار|150px|قوارير تحتوي على مواد كيميائية '''كيمياء''' هى فى الأصل كلمة إ...') |
ط (مراجعة واحدة) |
||
| (مراجعتان متوسطتان بواسطة مستخدمين اثنين آخرين غير معروضتين) | |||
| سطر 1: | سطر 1: | ||
[[ | {{علوم}} | ||
''' | {{رسالة توضيح 1|الكيمياء|اقسام وفروع الكيمياء|كيمياء (اقسام)|هنا}} | ||
[[ملف:Science-symbol-2.png|90px|يسار]] | |||
{{بوابة|كيمياء}} | |||
[[ملف:Chemicals in flasks.jpg|تصغير|يسار|[[مركبات كيميائية]] في قوارير مخبرية (منها [[هيدروكسيد الأمونيوم]] و[[حمض النيتريك]]) مضاءة بعدة ألوان]] | |||
[[ملف:String theory.svg|تصغير|مراحل التكبير:<br />1.المايكروسكوبية: المادة<br />2.جزيئية.<br />3.ذرية: بروتونات، نيترونات، الكترونات.<br />4. تحت ذرية: الكترونات.<br />5. تحت ذرية: الكوارك.<br />6. شريطية.]] | |||
[[ملف:VysokePece1.jpg|تصغير|يسار|تتكسر الأواصر ويعاد تشكيلها أثناء التفاعل الكيميائي، وينتج عن ذلك مواد مختلفة ذات خواص مختلفة، في فرن الصهر، يتفاعل أكسيد الحديد (مركب) مع أحادي أكسيد الكربون مكوناً [[حديد|الحديد]] (أحد [[عنصر كيميائي|العناصر الكيميائية]] بالإضافة إلى ثنائي أكسيد الكربون]] | |||
== تعريف الكيمياء == | |||
=== الكِيمِيَاءُ لغةً === | |||
'''الكِيمِيَاءُ - كِيمِيَاءُ :''' | |||
'''الكيمياء :''' الحِيلَة والحِذْق ، وكان يراد بها عنْد القدماءِ : تحويل بعض المعادن إِلى بعض . | |||
و '''( علمُ الكيمياء )''' عندهم : علمُ يُعْرَف به طرقُ سلب الخواضّ من الجواهر المعدِنية وجَلْبِ خاصَّةٍ جديدة إليها ، ولا سيّما تحويلُها إِلى ذهب . | |||
و '''( عند المحدثين ) :''' علمُ يتناول دراسة خواصّ العناصر والمركّبات والقوانين التي تحكم تفاعلاتها ، وبخاصَة عند اتحاد بعضها ببعضٍ :'''( التركيب )''' ، أَو تخليص بعضها من بعض : ''' (التحليل) ''' . | |||
'''( الكِيميَائيّ ، والكيمياوِيُّ ، والكيماويُّ ) :''' المتخصّص في علم الكيمياءِ أَو في تطبيق قواعده . والجمع : '''كيميائِيُّون ، وكيماويُّون ، وكيماوِيُّون .''' | |||
و'''التفاعل الكيميائي :''' أَن توثرَ مادَّةٌ في مادة أُخرى فتغير تركيبَها الكيميائي .أو هو تغيير كيميائي يحدث في المادة بتأثير الحرارة أَو الكهربا ونحوهما .<ref>http://www.almaany.com/home.php?language=arabic&word=%D9%83%D9%8A%D9%85%D9%8A%D8%A7%D8%A1&cat_group=1&lang_name=%D8%B9%D8%B1%D8%A8%D9%8A&type_word=2&dspl=0</ref> [[المعجم الوسيط]]. | |||
=== الكِيمِيَاءُ علمياً === | |||
'''الكيمياء''' [[علم]] [[مادة|المادة]]، وبخاصة خواصها، بنيتها، تركيبها، سلوكها، [[تفاعل]]اتها، وتداخلاتها التي تحدثها.<ref name=definition>{{cite web|url=http://chemweb.ucc.ie/what_is_chemistry.htm |title=What is Chemistry? |publisher=Chemweb.ucc.ie |date= |accessdate=2011-06-12}}</ref><ref name="Chemistry">[http://dictionary.reference.com/browse/Chemistry Chemistry]. (n.d.). Merriam-Webster's Medical Dictionary. Retrieved August 19, 2007.</ref> | |||
تسمى الكيمياء أحياناً بـ ('''العلم المركزي''') لأنها تربط الفيزياء مع [[علوم طبيعية|العلوم الطبيعية]] مثل [[علم الفلك]] [[جيولوجيا|والجيولوجيا]] و[[علم الأحياء]].<ref name="definition"/><ref name="Chemistry"/> | |||
تدرس الفيزياء المادة أيضاً ولكنها تدرس كميات الفضاء والمادة، والقوانين التي تحكمها، والكيمياء فرع من [[علوم فيزيائية|العلوم الفيزيائية]] ولكنها لا تتفرع عن ال[[فيزياء]].<ref>[http://www.springerlink.com/content/k97523j471763374/ Is chemistry a branch of physics? a paper by Mario Bunge]</ref> | |||
== النظرية == | |||
تبدأ الكيمياء التقليدية بدراسة [[جسيم أولي|الجسيمات الأولية]] و[[ذرة|الذرات]] و[[جزيء|الجزيئات]] و[[مادة كيميائية|المواد الكيميائية]] و[[بلورة|البلورات]] وأشكال التجمعات الأخرى للمادة وفي [[حالة المادة|الحالة]] الصلبة والسائلة والغازية معزولة عن بعضها أو متحدة مع بعضها. تنتج [[تآثر|التآثرات]] والتفاعلات والتحولات التي تدرسها الكيمياء من التآثر بين مواد كيميائية مختلفة أو بين [[مادة|المادة]] [[طاقة|والطاقة]]. يدرس هذا السلوك في [[مختبر|المختبر]] وباستخدام أشكال مختلفة من الأدوات المختبرية. | |||
[[ملف:Lab bench.jpg|تصغير|يمين|مختبر في قسم الكيمياء الحيوية، [[جامعة كولونيا]]]] | |||
[[تفاعل كيميائي|التفاعل الكيميائي]] هو تحول بعض المواد إلى مادة أخرى أو أكثر.<ref>IUPAC [[Gold Book]] [http://www.iupac.org/goldbook/C01033.pdf Definition]</ref> ويمكن استخدام الرموز للتعبير عنه بواسطة [[معادلة كيميائية]]. غالباً ما يكون عدد الذرات في طرفي المعادلة متساوياً، وتكون طبيعة التفاعلات الكيميائية والتغيرات في الطاقة التي تحدث نتيجة لهذه التفاعلات محكومة بقوانين تسمى القوانين الكيميائية، وتعد ملاحظة [[طاقة|الطاقة]] [[إنتروبيا|والإنتروبيا]] من الأمور المهمة في أغلب الدراسات الكيميائية. | |||
تصنف المواد الكيميائية حسب [[بنية|بنيتها]]، والطور بالإضافة إلى تركيبها الكيميائي. ويمكن تحليلها باستخدام أدوات [[كيمياء تحليلية|التحليل الكيميائي]]، مثل [[مطيافية|المطيافية]] [[استشراب|والاستشراب]]. | |||
== تاريخ الكيمياء == | |||
{{مقال تفصيلي|تاريخ الكيمياء}} | |||
الكيمياء هي إحدى العلوم الطبيعية التي عرفها الإنسان ومارسها منذ وقت بعيد لا تعرف له بداية، وقد ارتبط هذا الفن منذ الحضارات القديمة بالمعادن والتعدين وصناعة الألوان والطب والدواء وبعض الصناعات الفنية كدبغ الجلود وصبغ القماش وصناعة الزجاج، وحتى طبخ الطعام قد يصاحبه تغيرات كيميائية معينة مثل نبات [[كاسافا|الكاسافا]] الذي زرعه الأميرنديون في فنزويلا منذ آلاف السنين قبل الميلاد، وتحتوي جذور هذا النبات على [[حمض سيان الماء|حمض الهيدروسيانيك]] القاتل، وقد عرف الهنود الأمريكيون القدامى هذه المادة السامة وقاموا بالتخلص منها بالتسخين الذي يحول هذا الحمض إلى مواد غير سامة. | |||
واستخدم الإنسان منذ أكثر من ثلاثة آلاف سنة قبل الميلاد محلول الشب وبعض الصبغات المحضرة من العفص ولحاء بعض ثمار الأشجار وأوراق نبات السماق في تلوين الجلود والقماش. وما زال استخدام الصبغة المحضرة من أوراق وثمار نبات السماق موجوداً حتى اليوم للغرض نفسه في شمال العراق والشام وتركيا وغيرها. | |||
وقد نشأت الكيمياء كغيرها من العلوم في أروقة المعابد، وكانت من الفنون الخاصة جداً، وكانت حكراً على طائفة دون غيرها هم الكهنة.<ref>تاريخ العلوم والتكنولوجيا، في العصور القديمة والوسطى ومكانة الحضارة الإسلامية فيه، د. مصطفى محمود سليمان، ص229، الطبعة الثانية، الهيئة المصرية العامة للكتاب، 2008.</ref> | |||
===مساهمة العرب في تطوير الكيمياء=== | |||
{{مقال تفصيلي|الخيمياء والكيمياء في العهد الإسلامي}} | |||
عندما فتح العرب مصر سنة (642 م) ولا ريب أن أولئك الفاتحين أسهموا بقدرٍ موفور في تطوير الكيمياء، حيث يعتبرون أول من اشتغل بالكيمياء كعلم له قواعده وقوانينه، وذلك منذ القرن الثاني الهجري، وطبقوا إنتاجهم في الصيدلية بصفة خاصة. وما زال الالتحام بين شتى المفاهيم لعلوم الكيمياء القديمة ينم عن اللفظ العربي نفسه مثل (ألـ وخيمياء) وهو الشكل الإغريقي الذي يطلق على مصر. كذلك أصل كلمة كحول وهو عربي بمعنى غول وغرّبت هذه الكلمة أو حولت على اللغة الغربية بهذه الصفة. قال الله تعالي في سورة الصافات الآية(47): (لا فيها غول ولا هم عنها ينزفون). واستمرت أصول الكيمياء العربية مرجعاً للغرب إبان القرون الوسطى وانتقلت ترجمات أعمالهم إلى أوروبا في القرن الثاني عشر الميلادي والتي اشتهرت بعد أن وصل الفتح العربي إلى الأندلس سنة(711 م) يحمل معه المعارف العربية. وفي الجامعات العربية ببرشلونة وطليطلة تعلم طالبوا العلم من جميع أنحاء أوروبا فن الكيمياء. | |||
===الكيمياء الحديثة=== | |||
[[ملف:Antoine lavoisier color.jpg|تصغير|[[أنطوان لافوازييه]] عالم كيمياء فرنسي ، و معروف بأنه أبو الكيمياء الحديثة]] | |||
يرجع تاريخ الكيمياء الحديثة إلى القرن السابع عشر الميلادي بأبحاث (بويل) الذي قسم الأجسام إلى مواد أولية(عناصر ومركبات ومخاليط) وتلت أبحاث (بلاك، ولافوازييه)عن الاحتراق والتأكسد ثم(برتلي) الذي اكتشف الأكسجين في الهواء، ثم(كافندش) الذي اكتشف تكوين الماء ثم (دالتون) الذي وضع النظرية الذرية عن تكون المادة وتعرّف الكيمياء الحديثة بأنها:- علم طبيعي في تكوين المادة والتغييرات التي تحدث فيها تحت تغييرات مختلفة تفقد الجسم مظهره الخاص وصفاته التي يتميز بها، إذ تتبدل مادته بأخرى ذات خواص وصفات جديدة وتوصف مظاهر المواد وسلوكها بالخواص الكيميائية، أي تعرّف بذلك وتبين تلك الخواص الكيميائية إبان التفاعلات بالمعادلات. | |||
== أصل الكلمة == | |||
تعددت الآراء حول أصل كلمة (كيمياء) ومدلولها، فقد ذكر محمد بن أحمد في مفاتيح العلوم في القرن الرابع للهجرة<ref>محمد بن أحمد (أبو عبد الله الخوارزمي) 387 هـ، مفاتيح العلوم، إدارة الطباعة المنيرية، القاهرة.</ref>، أن كلمة كيمياء مشتقة من الكلمة العربية كمى ومعناها خفى وأستر، لأن هذا العلم كان متداولاً بين طائفة من الناس دون غيرها، بسبب الاعتقاد الذي سيطر على عقول الناس طيلة العصور الوسطى، وهو إمكانية تحويل المعادن البخسة إلى ذهب وفضة، وتحضير إكسير الحياة، ذلك السائل السحري الذي يعيد الصحة والشباب للإنسان، ومن ثم فقد حرص الكيميائيون القدامى على كتمان سر صنعتهم، وكتب بعض الكيميائيين العرب المتأخرىن نسبياً لا سيما بعد القرن الثاني عشر الميلادي معلومات في الكيمياء وتحويل المعادن إلى ذهب وفضة برموز وألغاز وتعمدوا الغموض والإرباك. | |||
وهناك من يعتقد أن أصل كلمة كيمياء مصري وهي كيم أو كمت kemt ومعناها الأرض السوداء وهي تربة وادي النيل، وذلك أن الكيمياء فن مصري قديم، وكانت تعرف آنذاك بسر الكهنة أو الصناعة التحتوية (نسبة إلى تحوت أو تحوتي أو جحوتي)<ref>عبد الحميد زايد (1966) مصر الخالدة، مقدمة في تاريخ مصر الفرعونية منذ أقدم العصور حتى 332 ق.م، دار النهضة العربية، القاهرة.</ref> وهو إله الحكمة المصري القديم الذي تقول الأساطير الفرعونية أنه ألف ما بين عشرين ألف إلى ستة وثلاثين ألف مجلد في كل العلوم ومنها الكيمياء<ref>ول ديورانت (1961)، قصة الحضارة، الجزء الثاني من المجلد الأول، الشرق الأدنى، ترجمة محمد بدران، لجنة التأليف والترجمة والنشر، القاهرة.</ref> وأنه علم الكهنة سر تحويل المعادن البخسة إلى ذهب وفضة، وتحضير إكسير الحياة. وكانا ليونان يعظمون تحوت ويسمونه هرمس أو أطرسمين (عطارد) المثلث العظمة ويسمى تحوت عند العرب إدريس وعند العبرانيين أخنوخ.<ref>ابن أبي أصيبعة، عيون الأنباء في طبقات الأطباء، مكتبة الحياة، بيروت 1965.</ref> | |||
ويعتقد اليونانيون أن اسقليبيوس (إله الطب عندهم) قد تعلم على يد هرمس، وقد أخذ اليونانيون فن الكيمياء عن المصريين، وانتقل منهم إلى الرومان فالمسلمين. | |||
وهناك فريق ثالث يرى أن كلمة كيمياء مشتقة من الكلمة الإغريقية خيما Chyma بمعنى التحليل والتفريق، ويرى غيرهم أن لفظة كيمياء قد حورت عن اللفظة العبرية (شامان) وتعني السر أو الغموض. | |||
والمرجح أن لفظة كيمياء عربية، وذلك لأن صناعة الكيمياء في العصور الوسطى كانت تعتمد على الكتمان وتحريم إذاعتها وإفضاء أسرارها لغير أهلها لكون هدفها تحويل المعادن البخسة إلى ذهب وفضة، واكتشاف الإكسير الذي يعيد الصحة والشباب إلى الإنسان، بالإضافة إلى ذلك فقد كانت الكيمياء من المعارف المغلفة بالغموض والكتمان، فقد أورد حاجي خليفة<ref>حاجي خليفة، كشف الظنون في أسامي الكتب والفنون، اسطنبول، 1941.</ref> صيغة وصية كيميائي لتلميذه يحذره فيها بكتمان سر هذه الصنعة وعدم إذاعتها، لأن في إذاعتها خراباً للعالم، ويذكر هذا المعنى جابر بن حيان مراراً في رسائله وكتبه، ولهذا نجد أن ابن خلدون<ref>ابن خلدون، المقدمة، دار الكشاف، بيروت.</ref> يهاجم أهل هذه الصنعة وكتاباتهم المليئة بالألغاز والطلسمات التي يتعذر فهمها.<ref>تاريخ العلوم والتكنولوجيا، في العصور القديمة والوسطى ومكانة الحضارة الإسلامية فيه، د. مصطفى محمود سليمان، ص229 - 231، الطبعة الثانية، الهيئة المصرية العامة للكتاب، 2008.</ref> | |||
===تعريفات=== | |||
تغير تعريف الكيمياء عبر العصور بسبب التطور الحاصل في النظريات والاكتشافات التي وسعت من مفهوم هذا العلم، وفيما يلي بعض التعريفات التي استخدمت في كتابات بعض الكيميائيين: | |||
* الكمي Alchemy: (330) هو دراسة تركيب الماء والحركة والنمو والتجسّد واستخراج الأرواح من الأجساد. (زوسيموس) <ref>Strathern, P. (2000). ''Mendeleyev’s Dream – the Quest for the Elements.'' New York: Berkley Books.</ref> | |||
* Chymistry (1661): موضوع المواد الأساسية للأجسام المتمازجة. [[روبرت بويل]] <ref>{{Cite book| last=Boyle | first = Robert |title=The Sceptical Chymist|location=New York | publisher=Dover Publications, Inc. (reprint)|year=1661|isbn=0486428257}}</ref> | |||
* Chymistry (1663) : فن علمي يستطيع الفرد من خلاله حل الأجسام، واستخراج المواد المختلفة المكونة لها، وكيفية دمجها مجدداً، ورفعها إلى مستوى أكثر كمالاً. (كلاسر)<ref>{{Cite book| last=Glaser | first = Christopher |title=Traite de la chymie|location=Paris | year=1663}} as found in: {{Cite book| last = Kim | first = Mi Gyung | title = Affinity, That Elusive Dream - A Genealogy of the Chemical Revolution | publisher = The MIT Press | year = 2003 | isbn = 0-262-11273-6}} | |||
</ref> | |||
* Chemistry (1730) : هو فن حل الأجسام الممتزجة أو المختلطة أو المجموعة إلى أجزاءها الرئيسية، وتركيب هذه الأجسام من هذه المواد. [[جورج ستال]]<ref>{{Cite book| last=Stahl | first = George, E. |title=Philosophical Principles of Universal Chemistry|location=London | year=1730}}</ref> | |||
* Chemistry (1837) : هو العلم الذي يهتم بالقوى الجزيئية وتأثيراتها وقوانينها. (دوماس)<ref>Dumas, J. B. (1837). 'Affinite' (lecture notes), vii, pg 4. “Statique chimique”, Paris: Academie des Sciences</ref> | |||
* Chemistry (1947) : هو علم المواد: بنيتها، خواصها، والتفاعلات التي تحولها إلى مواد أخرى [[لينوس باولنغ]]<ref>{{Cite book| last = Pauling | first = Linus | title = General Chemistry | publisher = Dover Publications, Inc. | year = 1947 | isbn = 0486656225}}</ref> | |||
* Chemistry (1998) : هو دراسة المادة والتأثيرات التي تحصل عليها.<ref>{{Cite book|author=Chang, Raymond |title=Chemistry, 6th Ed.|location=New York | publisher=McGraw Hill|year=1998|isbn=0-07-115221-0}}</ref> | |||
== المبادئ الأساسية == | |||
هنالك العديد من [[مفهوم|المفاهيم]] الأساسية في دراسة الكيمياء، ومنها:<ref>{{cite web|url=http://antoine.frostburg.edu/chem/senese/101/matter/ |title=General Chemistry Online - Companion Notes: Matter |publisher=Antoine.frostburg.edu |date= |accessdate=2011-06-12}}</ref> | |||
== | === الذرة === | ||
{{مقال تفصيلي|ذرة}} | |||
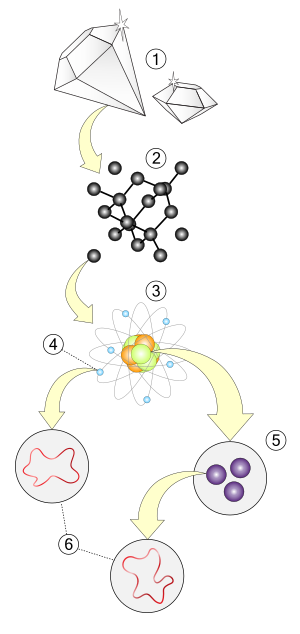
الذرة هي الوحدة الأساسية في الكيمياء، وتتكون من [[نواة الذرة|النواة]] موجبة الشحنة والتي تحتوي على [[بروتون|البروتونات]] و[[نيترون|النيترونات]] وتحتوي أيضاً عدداً من [[إلكترون|الإلكترونات]] التي تعمل على معادلة الشحنة الموجبة في النواة. كما أن الذرة هي أصغر وحدة يمكن تصورها والتي تكون قادرة على المحافظة على [[خاصية كيميائية|الخواص الكيميائية]] للعنصر، مثل [[سالبية كهربية|السالبية الكهربية]] و[[طاقة تأين|طاقة التأين]]، [[حالة الأكسدة|حالات الأكسدة]] المفضلة، [[عدد تساندي|عدد التساند]] وعدد [[رابطة|الروابط]] التي يفضل تشكيلها. (مثل [[فلز|الفلزية]] و[[أيون|الأيونية]] وال[[رابطة تساهمية|تساهمية]]). | |||
===العنصر=== | |||
العنصر هو المادة المتكونة من نوع واحد من الذرات، ويمتلك العنصر الكيميائي عدداً ثابتاً ومحدداً من البروتونات في نواة ذرته، ويعرف هذا العدد بالعدد الذري للعنصر. فمثلاً جميع الذرات التي تمتلك 6 بروتونات في أنويتها هي ذرات عنصر [[كربون|الكربون]]، وجميع الذارت التي تمتلك 92 بروتوناً في أنويتها هي ذرات عنصر [[يورانيوم|اليورانيوم]]. وهنالك 94 عنصراً متوفراً في الطبيعة بالإضافة إلى 18 عنصراً تم تصنيعها. | |||
== | على الرغم من احتواء جميع ذرات العنصر الواحد على نفس عدد البروتونات فإن ليس من اللازم احتواءها على نفس عدد النيترونات، تسمى مثل هذه الذرات [[نظير|بالنظائر]] ويمكن أن يمتلك العنصر الواحد أكثر من نظير واحد. | ||
أفضل تمثيل للعناصر الكيميائية هو [[الجدول الدوري]] والذي يرتب العناصر حسب عددها الذري، وتتشارك زمر ودورات العناصر في الجدول الدوري في بعض الخصائص أو تتبع نمطاً معيناً للخصائص، مثل قطر الذرة، والسالبية الكهربية، وغيرها. | |||
=== المركب === | |||
{{مقال تفصيلي|مركب كيميائي}} | |||
المركب الكيميائي هو مادة تتكون من نسبة معينة من العناصر وتحدد تركيب المركب والمجموعة التي يقع فيها هذا المركب والتي تحدد بالتالى خواص هذا المركب. فمثلاً ال[[ماء]] هو مركب يحتوى على [[هيدروجين|الهيدروجين]] [[أكسجين|الأكسجين]] بنسبة 2 إلى 1، حيث تكون ذرة الأكسجين محاطة بزوج من ذرات الهيدروجين وبزاوية قياسها 104.5 درجة. تتكون المركبات وتتحول عن طريق التفاعلات الكيميائية. | |||
== | ===المادة=== | ||
{{مقال تفصيلي|مادة كيميائية}} | |||
المادة الكيميائية هي نوع من المادة له تركيب معلوم ومجموعة من الخواص.<ref>{{Cite book| title = General Chemistry | author = Hill, J.W.; Petrucci, R.H.; McCreary, T.W.; Perry, S.S. | edition = 4th | publisher = Pearson Prentice Hall | location = Upper Saddle River, NJ | year = 2005 | page = 37}}</ref> ولكن وبشكل دقيق لا يعد مزيج من المركبات أو العناصر أو المركبات والعناصر مادة كيميائية. تعد الكثير من المواد التي نراها في حياتنا اليومية نوعاً من أنواع الأمزجة، مثل: ال[[هواء]]، [[سبيكة|السبائك]]، و[[كتلة حيوية|الكتل الحيوية]]. | |||
=== الجزيئة === | |||
{{مقال تفصيلي|جزيء}} | |||
الجزيئة هي أصغر جزء غير قابل للتقسيم من المادة الكيميائية النقية، والتي تمتلك مجموعة فريدة من الخواص التابعة لها، بمعنى قدرتها إحداث مجموعة معينة من التفاعلات مع المواد الأخرى. يمكن أن تتواجد الجزيئات على شكل وحدات متعادلة كهربائياً على عكس [[أيون|الأيونات]]. تعد الجزيئات مجموعة من الذرات المرتبطة مع بعضها بروابط تساهمية، ومثل هذه البنى متعادل كهربائياً وتكون جميع الأغلفة التكافؤية متزاوجة مع الكترونات أخرى بواسطة الأواصر أو [[زوج وحيد|الأزواج الوحيدة]]. | |||
لا تحتوي جميع المواد على جزيئات مجردة، فغالبية العناصر الكيميائية مكونة من ذرات وحيدة تمثل الوحدة المجردة الصغرى. وتنتظم الأنواع الأخرى من المواد مثل المركبات الأيونية والشبكات الصلبة بطريقة تقلل من وجود جزيئة يمكن التعرف عليها. وتدرس هذه المواد بالاعتماد على وحدات الصيغة أو [[بنية بلورية|البناء البلوري]] كأصغر وحدة متكررة بنيوية ضمن المادة، وذلك لعدم وجود جزيئات يمكن التعرف عليها. | |||
[[ملف:Taxol.svg|تصغير|400بك|البنية الذرية وتظهر فيها الأواصر والمواقع النسبية للذرات في الجزيئة كما هو الحال في [[باكليتاكسيل|الباكليتاكسيل]]]] | |||
===المول وكمية المادة=== | |||
{{مقال تفصيلي|مول}} | |||
المول وحدة لقياس كمية المادة، وهو عبارة عن كمية المادة التي تحتوي على (ذرات أو جزيئات أو أيونات) بقدر ما يحتويه 0.012 كلغم (12 غرام) من [[كربون]]-12، عندما تكون ذرات الكربون غير مرتبطة ومستقرة في [[حالة قاعية|الحالة القاعية]]<ref>{{cite web|url=http://www.bipm.org/en/si/base_units/ |title=Official SI Unit definitions |publisher=Bipm.org |date= |accessdate=2011-06-12}}</ref> | |||
== | === الشوارد (الأيونات) والأملاح === | ||
{{مقال تفصيلي|أيون}} | |||
الشاردة هو مركب مشحون, أو هو ذرة أو جزيئ اكتسب أو فقد إكتروناً أو أكثر. الأيونات الموجبة الشحنة تسمى [[شرجبة]] (كاتيونات) مثل كاتيون [[صوديوم|الصوديوم]] NaNa<sup>+</sup> والأيونات السالبة الشحنة تسمى [[شرسبة]] (أنيون) مثل شرسبة (أنيون) [[كلور|الكلور]] Cl<sup>-</sup>, واللذان عن إتحادهما يكونا الملح المتعادل [[كلوريد الصوديوم]](NaCl). ومثل للأيونات ذات الذرات العديدة التي لا تتفكك خلال تفاعلات الحمض - القاعدة هو مجموعة [[هيدروكسيد|الهيدروكسيد]] (OH<sup>-</sup>), أو [[فوسفات|الفوسفات]]). | |||
تعرف الأيونات في الحالة الغازية [[بلازما (فيزياء)|بالبلازما]]. | |||
===الحامضية والقاعدية=== | |||
{{مقال تفصيلي|تفاعل حمض-قاعدة}} | |||
غالباً ما تصنف المادة كحامض وقاعدة (قلوي). وهناك نظريات متعددة شرحت السلوك الحامضي-القاعدي، أبسط هذه النظريات هي نظرية أرينوس، والتي تنص على أن الحامض هو المادة التي تنتج أيونات الهيدرونيوم عند إذابتها في الماء، وأن القاعدة هي المادة التي تنتج أيون الهيدروكسايد عند إذابتها في الماء. | |||
أما نظرية برونشتد-لوري للحامضية والقاعدية، فتعد الحامض المادة التي تمنح أيون الهيدروجين موجب الشحنة إلى مادة أخرى ضمن تفاعل كيميائي، وبالتالي تكون القاعدة هي المادة التي تستقبل أيون الهيدروجين. | |||
أما نظرية لويس فتعتمد على عملية تكوين أواصر كيميائية جديدة، فالحامض هو المادة القادرة على تقبل مزدوج إلكتروني من مادة أخرى أثناء عملية تكوين الأواصر، والقاعدة هي المادة التي تستطيع توفير مزدوج إلكتروني لتكوين آصرة جديدة. | |||
=== | === الطور === | ||
{{مقال تفصيلي|طور (مادة)}} | |||
بالإضافة إلى الخواص الكيميائية المعينة التي تتصف بها المواد الكيميائية فإن الأخير تتواجد أيضاً بأطوار متعددة. وعلى الأغلب فإن تصنيف المواد الكيميائية لا يرتبط بهذه تصنيف الأطوار، مع إمكانية عدم توافق بعض الأطوار مع بعض الخواص الكيميائية. | |||
يعرف الطور بأنه مجموعة من الحالات للنظام الكيميائي والتي تمتلك نفس الخواص البنيوية، في مدى معين من الظروف، مثل الضغط ودرجة الحرارة. تميل بعض الخواص الفيزيائية مثل الكثافة ومعامل الانكسار إلى كونها خواص مميزة للطور. | |||
=== | ===الأكسدة والاختزال=== | ||
{{مقال تفصيلي|تفاعلات أكسدة-اختزال}} | |||
مفهوم يرتبط بقابلية ذرات المواد المختلفة على اكتساب وفقدان الإلكترونات. حيث تدعى المواد القادرة على أكسدة المواد الأخرى بالمؤكسدات وتعرف ب[[مؤكسد|العوامل المؤكسدة]]. يقوم العامل المؤكسد بإزالة الإلكترونات من المواد الأخرى. وتدعى المواد القادرة على اختزال المواد الأخرى بالمواد المختزلة أو [[مختزل|العامل المختزل]]. يقوم العامل المختزل بنقل الإلكترونات إلى المواد الأخرى، وبالتالي تحصل في العامل المختزل عملية الأكسدة، ويسمى العامل المختزل كذلك بمانح الإلكترون لقيامه بهذه الوظيفة. ترمز عملية الأكسدة والاختزال إلى التغير في عدد التأكسد، وقد لا يحدث الانتقال الفعلي للاكترونات، لذا فمن المفضل أن نعرف الأكسدة بأنها العملية التي تقوم بزيادة عدد التأكسد، والاختزال بأنه العملية التي تقلل عدد التأكسد. | |||
==الروابط الكيميائية== | === الروابط الكيميائية === | ||
الرابطة الكيميائية | الرابطة الكيميائية هي القوة التي تربط الذرات في الجزيء أو في البلورة. في مركبات بسيطة عديدة, نظرية التكافؤ ومبدأ عدد التأكسد يمكن استخدامهما للتنبؤ بالتركيب الجزيئي. وبالمثل, فإن النظريات الفيزياء الكلاسيكية يمكن استخدامها للتنبؤ بتركيب مركبات أيونية عديدة. أما المركبات ذات التركيب المعقد، مثل السبائك المعدنية، فإن نظرية التكافؤ لا تستطيع تفسير تركيبها, وهنا تظهر أهمية استخدام نظريات [[الميكانيكا الكمية]] مثل نظرية [[المدار الجزيئي]]. | ||
بعض أنواع الروابط الكيميائية: | بعض أنواع الروابط الكيميائية: | ||
#رابطة أيونية | # رابطة أيونية | ||
#رابطة تساهمية | # رابطة تساهمية | ||
#رابطة فلزية | # رابطة فلزية | ||
ورابطة تناسقية | ورابطة تناسقية | ||
والرابطة التناسقية تنساق تحت الرابطة التساهمية تقريبا | والرابطة التناسقية تنساق تحت الرابطة التساهمية تقريبا وتوجد رابطة أخرى وهي الرابطة الهيدروجينية وتتكون عن طريق اتحاد جزيئين بحيث يكون بكل جزئ ذرة هيدروجين وذرة أخرى ذات سالبيه كهربيه عاليه والذي يؤدى إلى وقوع ذرة الهيدروجين بين ذرتين ذات سالبيه كهربيه عاليه عند الاتحاد. | ||
الرابطة الأيونية : تتكون غالباً بين الفلزات واللافلزات حيث تكون : | |||
'''الفلزات :''' ذراتها حجمها كبير - جهد تأينها صغير (فيسهل فقد الكترونات المستوى الأخير) فيتكون أيون موجب ليصل لأقرب غاز خامل. | |||
'''اللافلزات :''' صغيرة الحجم - ميلها الإلكتروني كبير (فيسهل اكتساب إلكترونات) فتصبح أيون سالب لتصل لأقرب غاز خامل (نبيل). | |||
والربطة الأيونية هي : انجذاب كهربائي بين الأيون الموجب والسالب (وليس لها وجود مادي). | |||
===التفاعل=== | |||
[[تفاعل كيميائي|التفاعل الكيميائي]] هو تحول في التركيب الدقيق للجزيئات. ويمكن أن ينتج التفاعل الكيميائي من مهاجمة جزيئات لجزيئات أخرى لتكوين جزيئات أكبر, أو جزيئات تتفكك لتكوين جزيئين أو أكثر أقل حجما, أو إعادة ترتيب الذرات في نفس الجزيء أو خلال جزيئات أخرى. وتتضمن التفاعلات الكيميائية غالبا تكوين أو تكسير روابط كيميائية. | |||
===التوازن=== | |||
{{مقال تفصيلي|توازن كيميائي}} | |||
على الرغم من انتشار مفهوم التوازن بشكل واسع في العلوم، إلا أنه يظهر في أدبيات الكيمياء كلما توفر عدد من الحالات المختلفة في التركيب الكيميائي. على سبي المثال، في خليط من مركبات كيميائية مختلفة يمكنها التفاعل مع بعضها، أو مادة بمقدورها التواجد بأكثر من حالة. لا يعد نظام من المواد الكيميائية في حالة التوازن - على الرغم من امتلاكه لتركيب غير متغير - [[توازن ميكانيكي|ثابتاً]]، لأن الجزيئات في حالة تفاعل مستمر مع بعضهاالبعض، وهذا يؤدي إلى ظهور حالة [[توازن دينامي|التوازن الدينامي]]. لذا فإن المفهوم يصف الحالة التي تكون فيها متغيرات مثل التركيب الكيميائي ثابتة مع مرور الوقت. لا تكون المواد الكيميائية الموجودة في الأنظمة الحية في حالة توازن، وإنما هي بعيدة جداً عن حالة التوازن. | |||
===الطاقة=== | |||
{{مقال تفصيلي|طاقة}} | |||
في السياقات الكيميائية، ترتبط الطاقة بالمادة نتيجة لبنيتها الذرية أو الجزيئية، وبما أن التحولات الكميائية مرتبطة بتحول واحد أو أكثر من هذه البنى، فإن زيادة أو نقصاناً في الطاقة تكون مرافقة لهذه العملية. يتم تبادل بعض الطاقة بين بين المحيط والمواد المتفاعلة على شكل [[حرارة]] أو [[ضوء]]، لذا تكون طاقة المواد الناتجة أكثر أو أقل من طاقة المواد المتفاعل. يكون التفاعل باعثاً للحرارة إلى المحيط، وقد يكون التفاعل ماصاً للحرارة من المحيط. | |||
يساعد وجود مراحل طاقة معينة للمواد الكيميائية المختلة على تشخيصها بواسطة تحليل [[خطوط الطيف]]. وتستخدم أنواع مختلفة من الأطياف في [[مطيافية|المطيافية]] الكيميائية، مثل [[مطيافية الأشعة تحت الحمراء]]، الأمواج القصيرة، و[[رنين نووي مغناطيسي|الرنين النووي المغناطيسي]]. | |||
[[ملف:Emission spectrum-Fe.svg|none|frame|طيف إشعاع [[حديد|الحديد]]]] | |||
===قوانين الكيمياء=== | |||
تخضع التفاعلات الكيميائية لقوانين محددة، والتي أصبحت مفاهيم أساسية في الكيمياء، وهذه بعض القوانين: | |||
* [[قانون أفوجادرو]] | |||
[[ | * [[قانون بير لامبرت]] | ||
* [[قانون شارل]] | |||
* [[قانون فيك للانتشار]] | |||
* [[قانون جاي لوساك]] | |||
* [[مبدأ لو شاتيليه]] | |||
* [[قانون هنري]] | |||
* [[قانون هس]] | |||
* قانون [[بقاء الطاقة]] الذي أدى إلى اكتشاف مفاهيم مهمة مثل [[توازن|التوازن]] و[[ديناميكا حرارية|الديناميكا الحرارية]] و[[حركية كيميائية|الحركية الكيميائية]]. | |||
* [[قانون بقاء المادة]] | |||
* [[قانون النسب الثابتة]] | |||
* [[قانون النسب المتضاعفة]] | |||
* [[قانون راؤول]] | |||
== | == نظام التسمية في الكيمياء == | ||
التسمية ترجع إلى النظام المتبع لتسمية المركبات الكيميائية. يوجد نظام معين لتسمية المواد الكيميائية. المركبات العضوية يتم تسميتها طبقا لنظام تسمية المركبات الكيميائية. المركبات غير العضوية يتم تسميتها طبقا لنظام تسمية المركبات غير العضوية. ويسمى ذلك IUPAC وهي اختصار '''{{إنك|International Union of Pure and Applied Chemistry}}''' أي الأتحاد الدولي للكيمياء النظرية والتطبيقية. | |||
==فروع الكيمياء== | |||
تقسم الكيمياء إلى عدة فروع رئيسية ومنها : | |||
تنقسم الكيمياء بصفة عامة إلى عدة فروع رئيسية، كما يوجد أيضا تفرعات لهذه الفروع, وموضوعات ذات تخصص أكبر داخل هذه الفروع. | |||
; [[كيمياء تحليلية|الكيمياء التحليلية]]: هي تحليل عينات من المادة لمعرفة التركيب الكيميائى لها وكيفية بنائها. | |||
; [[كيمياء حيوية|الكيمياء الحيوية]]:هي دراسة المواد الكيميائية، والتفاعلات الكيميائية التي تحدث في الكائنات الحية. | |||
;[[كيمياء غير عضوية|الكيمياء غير العضوية]]: هي دراسة خواص وتفاعلات المركبات غير العضوية. ولا يوجد هناك حد واضح للتفريق بين الكيمياء العضوية وغير العضوية، كما أن هناك تداخل كبير بينهما, ويكون أهمه في فرع آخر يسمى كيمياء الفلزات العضوية. | |||
;[[كيمياء عضوية]]: هي دراسة تركيب، وخواص، وتفاعلات المركبات العضوية. | |||
;[[كيمياء فيزيائية|الكيمياء الفيزيائية]]: هي دراسة الأصل الفيزيائى للتفاعلات والأنظمة الكيميائية. ولمزيد من التحديد فإنها تدرس تغييريات حالات الطاقة في التفاعلات الكيميائية. ومن الفروع التي تهم الكيميائيين المتخصصين في [[كيمياء حرارية|الكيمياء الحرارية]]، [[كيمياء حركية|الكيمياء الحركية]]، [[كيمياء كم|كيمياء الكم]]، [[الميكانيكا الإحصائية]]، [[علم طيف|علم الأطياف]]. | |||
==الصناعة الكيميائية== | |||
{{مقال تفصيلي|صناعة كيميائية}} | |||
تمثل الصناعة الكيميائية نشاطاً اقتصادياً مهماً، حيث قدرت مبيعات أكبر 50 مصنعاً للمواد الكيميائية في العالم سنة 2004 بـ 587 مليار دولار أمريكي وبهامش ربح 8.1% ومصاريف بحث وتطوير بنسبة 2.1% من مجمل المبيعات.<ref>{{Cite journal| title = Top 50 Chemical Producers | journal = Chemical & Engineering News | date = July 18, 2005 | volume = 83 | issue = 29 | pages = 20–23 | url = http://pubs.acs.org/cen/coverstory/83/8329globaltop50.html}}</ref> | |||
== هيئات مختصة بالكيمياء == | |||
[[ملف:مصلحة الكيمياء.JPG|تصغير|250بك|<div style="text-align: center;">مصلحة الكيمياء [[القاهرة|بمدينة القاهرة]].</div>]] | |||
* المجتمع الكيميائي الأمريكي. | |||
* المجتمع الأمريكي للكيمياء العصبية. | |||
* المؤسسة الكندية للكيمياء. | |||
* المجتمع الكيميائي في البيرو. | |||
* [[الاتحاد الدولي للكيمياء البحتة والتطبيقية]]. | |||
* المؤسسة الملكية الأسترالية للكيمياء. | |||
* المجتمع الملكي الهولندي للكيمياء. | |||
* المجتمع الملكي للكيمياء في بريطانيا RSC. | |||
* مجتمع التصنيع الكيميائي. | |||
* مصلحة الكيمياء، [[القاهرة]]. | |||
== انظر أيضا == | == انظر أيضا == | ||
*[[تاريخ كيمياء| | {{ويكاموس|كِيمْيَاء}} | ||
*[[خيمياء]] | * [[تاريخ الكيمياء]] | ||
*[[ | * [[قائمة الموضوعات الكيميائية|قائمة بموضوعات الكيمياء]] | ||
*[[تسلسل تاريخي لاكتشاف العناصر|التسلسل | * [[قائمة أشهر الكيميائيين]] | ||
*[[جائزة نوبل | * [[كيميائي]] | ||
* [[تعليم كيمياء]] | |||
* [[قائمة مركبات كيميائية|قائمة المركبات]] | |||
* [[الكيمياء العربية]] | |||
* [[خيمياء]] | |||
* [[اكتشاف العناصر الكيميائية]] | |||
* [[تسلسل تاريخي لاكتشاف العناصر|التسلسل التاريخي لاكتشاف العناصر]] | |||
* [[جدول دوري|الجدول الدوري]] | |||
* [[جائزة نوبل في الكيمياء]] | |||
* [[هندسة كيميائية]] | * [[هندسة كيميائية]] | ||
* [[ | * [[علامات أوروبية للجودة الكيميائية]] | ||
== | == وصلات خارجية == | ||
{{ويكي مصدر|تصنيف:كيمياء|كيمياء}} | |||
* [http://www.chem.qmw.ac.uk/iupac/ صفحة التسمية الرئيسية, ويفضل قراءة الكتاب الذهبي الذي يحتوى على تعريفات التسميات الكيميائية الأساسية] | |||
* [http://physchem.ox.ac.uk/MSDS/ بيانات الأمن والسلامة لعديد من المواد الكيماوية] | |||
* [http://www.flinnsci.com/search_MSDS.asp بيانات الصحة والسلامة] | |||
* [http://chem.sis.nlm.nih.gov/chemidplus/ قاعدة بيانات الكيمياء وتتضمن بيانات أساسية ومعلومات عن السموم] | |||
* [http://www.allchemicals.info/ قاموس الكيمياء] | |||
* [http://www.cci.ethz.ch/index.html صور ومقاطع فيديو لبعض التكنيكات والتجارب] | |||
==المراجع== | |||
{{مراجع}} | |||
== | |||
{{علوم طبيعية}} | |||
{{فروع الكيمياء}} | {{فروع الكيمياء}} | ||
[[تصنيف:علوم طبيعية]] | |||
[[تصنيف:علوم فيزيائية]] | |||
[[تصنيف:كيمياء|*]] | |||
[[تصنيف:قائمة أسماء العلوم]] | |||
{{وصلة مقالة جيدة|sr}} | |||
{{وصلة مقالة مختارة|fo}} | |||
{{وصلة مقالة مختارة|sl}} | |||
{{وصلة مقالة مختارة|zh-yue}} | |||
المراجعة الحالية بتاريخ 14:32، 16 سبتمبر 2013
خطأ: لا توجد وحدة بهذا الاسم "Sidebar".

تعريف الكيمياء
الكِيمِيَاءُ لغةً
الكِيمِيَاءُ - كِيمِيَاءُ : الكيمياء : الحِيلَة والحِذْق ، وكان يراد بها عنْد القدماءِ : تحويل بعض المعادن إِلى بعض . و ( علمُ الكيمياء ) عندهم : علمُ يُعْرَف به طرقُ سلب الخواضّ من الجواهر المعدِنية وجَلْبِ خاصَّةٍ جديدة إليها ، ولا سيّما تحويلُها إِلى ذهب . و ( عند المحدثين ) : علمُ يتناول دراسة خواصّ العناصر والمركّبات والقوانين التي تحكم تفاعلاتها ، وبخاصَة عند اتحاد بعضها ببعضٍ :( التركيب ) ، أَو تخليص بعضها من بعض : (التحليل) . ( الكِيميَائيّ ، والكيمياوِيُّ ، والكيماويُّ ) : المتخصّص في علم الكيمياءِ أَو في تطبيق قواعده . والجمع : كيميائِيُّون ، وكيماويُّون ، وكيماوِيُّون .
والتفاعل الكيميائي : أَن توثرَ مادَّةٌ في مادة أُخرى فتغير تركيبَها الكيميائي .أو هو تغيير كيميائي يحدث في المادة بتأثير الحرارة أَو الكهربا ونحوهما .[1] المعجم الوسيط.
الكِيمِيَاءُ علمياً
الكيمياء علم المادة، وبخاصة خواصها، بنيتها، تركيبها، سلوكها، تفاعلاتها، وتداخلاتها التي تحدثها.[2][3]
تسمى الكيمياء أحياناً بـ (العلم المركزي) لأنها تربط الفيزياء مع العلوم الطبيعية مثل علم الفلك والجيولوجيا وعلم الأحياء.[2][3]
تدرس الفيزياء المادة أيضاً ولكنها تدرس كميات الفضاء والمادة، والقوانين التي تحكمها، والكيمياء فرع من العلوم الفيزيائية ولكنها لا تتفرع عن الفيزياء.[4]
النظرية
تبدأ الكيمياء التقليدية بدراسة الجسيمات الأولية والذرات والجزيئات والمواد الكيميائية والبلورات وأشكال التجمعات الأخرى للمادة وفي الحالة الصلبة والسائلة والغازية معزولة عن بعضها أو متحدة مع بعضها. تنتج التآثرات والتفاعلات والتحولات التي تدرسها الكيمياء من التآثر بين مواد كيميائية مختلفة أو بين المادة والطاقة. يدرس هذا السلوك في المختبر وباستخدام أشكال مختلفة من الأدوات المختبرية.

التفاعل الكيميائي هو تحول بعض المواد إلى مادة أخرى أو أكثر.[5] ويمكن استخدام الرموز للتعبير عنه بواسطة معادلة كيميائية. غالباً ما يكون عدد الذرات في طرفي المعادلة متساوياً، وتكون طبيعة التفاعلات الكيميائية والتغيرات في الطاقة التي تحدث نتيجة لهذه التفاعلات محكومة بقوانين تسمى القوانين الكيميائية، وتعد ملاحظة الطاقة والإنتروبيا من الأمور المهمة في أغلب الدراسات الكيميائية.
تصنف المواد الكيميائية حسب بنيتها، والطور بالإضافة إلى تركيبها الكيميائي. ويمكن تحليلها باستخدام أدوات التحليل الكيميائي، مثل المطيافية والاستشراب.
تاريخ الكيمياء
الكيمياء هي إحدى العلوم الطبيعية التي عرفها الإنسان ومارسها منذ وقت بعيد لا تعرف له بداية، وقد ارتبط هذا الفن منذ الحضارات القديمة بالمعادن والتعدين وصناعة الألوان والطب والدواء وبعض الصناعات الفنية كدبغ الجلود وصبغ القماش وصناعة الزجاج، وحتى طبخ الطعام قد يصاحبه تغيرات كيميائية معينة مثل نبات الكاسافا الذي زرعه الأميرنديون في فنزويلا منذ آلاف السنين قبل الميلاد، وتحتوي جذور هذا النبات على حمض الهيدروسيانيك القاتل، وقد عرف الهنود الأمريكيون القدامى هذه المادة السامة وقاموا بالتخلص منها بالتسخين الذي يحول هذا الحمض إلى مواد غير سامة. واستخدم الإنسان منذ أكثر من ثلاثة آلاف سنة قبل الميلاد محلول الشب وبعض الصبغات المحضرة من العفص ولحاء بعض ثمار الأشجار وأوراق نبات السماق في تلوين الجلود والقماش. وما زال استخدام الصبغة المحضرة من أوراق وثمار نبات السماق موجوداً حتى اليوم للغرض نفسه في شمال العراق والشام وتركيا وغيرها. وقد نشأت الكيمياء كغيرها من العلوم في أروقة المعابد، وكانت من الفنون الخاصة جداً، وكانت حكراً على طائفة دون غيرها هم الكهنة.[6]
مساهمة العرب في تطوير الكيمياء
عندما فتح العرب مصر سنة (642 م) ولا ريب أن أولئك الفاتحين أسهموا بقدرٍ موفور في تطوير الكيمياء، حيث يعتبرون أول من اشتغل بالكيمياء كعلم له قواعده وقوانينه، وذلك منذ القرن الثاني الهجري، وطبقوا إنتاجهم في الصيدلية بصفة خاصة. وما زال الالتحام بين شتى المفاهيم لعلوم الكيمياء القديمة ينم عن اللفظ العربي نفسه مثل (ألـ وخيمياء) وهو الشكل الإغريقي الذي يطلق على مصر. كذلك أصل كلمة كحول وهو عربي بمعنى غول وغرّبت هذه الكلمة أو حولت على اللغة الغربية بهذه الصفة. قال الله تعالي في سورة الصافات الآية(47): (لا فيها غول ولا هم عنها ينزفون). واستمرت أصول الكيمياء العربية مرجعاً للغرب إبان القرون الوسطى وانتقلت ترجمات أعمالهم إلى أوروبا في القرن الثاني عشر الميلادي والتي اشتهرت بعد أن وصل الفتح العربي إلى الأندلس سنة(711 م) يحمل معه المعارف العربية. وفي الجامعات العربية ببرشلونة وطليطلة تعلم طالبوا العلم من جميع أنحاء أوروبا فن الكيمياء.
الكيمياء الحديثة

يرجع تاريخ الكيمياء الحديثة إلى القرن السابع عشر الميلادي بأبحاث (بويل) الذي قسم الأجسام إلى مواد أولية(عناصر ومركبات ومخاليط) وتلت أبحاث (بلاك، ولافوازييه)عن الاحتراق والتأكسد ثم(برتلي) الذي اكتشف الأكسجين في الهواء، ثم(كافندش) الذي اكتشف تكوين الماء ثم (دالتون) الذي وضع النظرية الذرية عن تكون المادة وتعرّف الكيمياء الحديثة بأنها:- علم طبيعي في تكوين المادة والتغييرات التي تحدث فيها تحت تغييرات مختلفة تفقد الجسم مظهره الخاص وصفاته التي يتميز بها، إذ تتبدل مادته بأخرى ذات خواص وصفات جديدة وتوصف مظاهر المواد وسلوكها بالخواص الكيميائية، أي تعرّف بذلك وتبين تلك الخواص الكيميائية إبان التفاعلات بالمعادلات.
أصل الكلمة
تعددت الآراء حول أصل كلمة (كيمياء) ومدلولها، فقد ذكر محمد بن أحمد في مفاتيح العلوم في القرن الرابع للهجرة[7]، أن كلمة كيمياء مشتقة من الكلمة العربية كمى ومعناها خفى وأستر، لأن هذا العلم كان متداولاً بين طائفة من الناس دون غيرها، بسبب الاعتقاد الذي سيطر على عقول الناس طيلة العصور الوسطى، وهو إمكانية تحويل المعادن البخسة إلى ذهب وفضة، وتحضير إكسير الحياة، ذلك السائل السحري الذي يعيد الصحة والشباب للإنسان، ومن ثم فقد حرص الكيميائيون القدامى على كتمان سر صنعتهم، وكتب بعض الكيميائيين العرب المتأخرىن نسبياً لا سيما بعد القرن الثاني عشر الميلادي معلومات في الكيمياء وتحويل المعادن إلى ذهب وفضة برموز وألغاز وتعمدوا الغموض والإرباك.
وهناك من يعتقد أن أصل كلمة كيمياء مصري وهي كيم أو كمت kemt ومعناها الأرض السوداء وهي تربة وادي النيل، وذلك أن الكيمياء فن مصري قديم، وكانت تعرف آنذاك بسر الكهنة أو الصناعة التحتوية (نسبة إلى تحوت أو تحوتي أو جحوتي)[8] وهو إله الحكمة المصري القديم الذي تقول الأساطير الفرعونية أنه ألف ما بين عشرين ألف إلى ستة وثلاثين ألف مجلد في كل العلوم ومنها الكيمياء[9] وأنه علم الكهنة سر تحويل المعادن البخسة إلى ذهب وفضة، وتحضير إكسير الحياة. وكانا ليونان يعظمون تحوت ويسمونه هرمس أو أطرسمين (عطارد) المثلث العظمة ويسمى تحوت عند العرب إدريس وعند العبرانيين أخنوخ.[10]
ويعتقد اليونانيون أن اسقليبيوس (إله الطب عندهم) قد تعلم على يد هرمس، وقد أخذ اليونانيون فن الكيمياء عن المصريين، وانتقل منهم إلى الرومان فالمسلمين.
وهناك فريق ثالث يرى أن كلمة كيمياء مشتقة من الكلمة الإغريقية خيما Chyma بمعنى التحليل والتفريق، ويرى غيرهم أن لفظة كيمياء قد حورت عن اللفظة العبرية (شامان) وتعني السر أو الغموض.
والمرجح أن لفظة كيمياء عربية، وذلك لأن صناعة الكيمياء في العصور الوسطى كانت تعتمد على الكتمان وتحريم إذاعتها وإفضاء أسرارها لغير أهلها لكون هدفها تحويل المعادن البخسة إلى ذهب وفضة، واكتشاف الإكسير الذي يعيد الصحة والشباب إلى الإنسان، بالإضافة إلى ذلك فقد كانت الكيمياء من المعارف المغلفة بالغموض والكتمان، فقد أورد حاجي خليفة[11] صيغة وصية كيميائي لتلميذه يحذره فيها بكتمان سر هذه الصنعة وعدم إذاعتها، لأن في إذاعتها خراباً للعالم، ويذكر هذا المعنى جابر بن حيان مراراً في رسائله وكتبه، ولهذا نجد أن ابن خلدون[12] يهاجم أهل هذه الصنعة وكتاباتهم المليئة بالألغاز والطلسمات التي يتعذر فهمها.[13]
تعريفات
تغير تعريف الكيمياء عبر العصور بسبب التطور الحاصل في النظريات والاكتشافات التي وسعت من مفهوم هذا العلم، وفيما يلي بعض التعريفات التي استخدمت في كتابات بعض الكيميائيين:
- الكمي Alchemy: (330) هو دراسة تركيب الماء والحركة والنمو والتجسّد واستخراج الأرواح من الأجساد. (زوسيموس) [14]
- Chymistry (1661): موضوع المواد الأساسية للأجسام المتمازجة. روبرت بويل [15]
- Chymistry (1663) : فن علمي يستطيع الفرد من خلاله حل الأجسام، واستخراج المواد المختلفة المكونة لها، وكيفية دمجها مجدداً، ورفعها إلى مستوى أكثر كمالاً. (كلاسر)[16]
- Chemistry (1730) : هو فن حل الأجسام الممتزجة أو المختلطة أو المجموعة إلى أجزاءها الرئيسية، وتركيب هذه الأجسام من هذه المواد. جورج ستال[17]
- Chemistry (1837) : هو العلم الذي يهتم بالقوى الجزيئية وتأثيراتها وقوانينها. (دوماس)[18]
- Chemistry (1947) : هو علم المواد: بنيتها، خواصها، والتفاعلات التي تحولها إلى مواد أخرى لينوس باولنغ[19]
- Chemistry (1998) : هو دراسة المادة والتأثيرات التي تحصل عليها.[20]
المبادئ الأساسية
هنالك العديد من المفاهيم الأساسية في دراسة الكيمياء، ومنها:[21]
الذرة
الذرة هي الوحدة الأساسية في الكيمياء، وتتكون من النواة موجبة الشحنة والتي تحتوي على البروتونات والنيترونات وتحتوي أيضاً عدداً من الإلكترونات التي تعمل على معادلة الشحنة الموجبة في النواة. كما أن الذرة هي أصغر وحدة يمكن تصورها والتي تكون قادرة على المحافظة على الخواص الكيميائية للعنصر، مثل السالبية الكهربية وطاقة التأين، حالات الأكسدة المفضلة، عدد التساند وعدد الروابط التي يفضل تشكيلها. (مثل الفلزية والأيونية والتساهمية).
العنصر
العنصر هو المادة المتكونة من نوع واحد من الذرات، ويمتلك العنصر الكيميائي عدداً ثابتاً ومحدداً من البروتونات في نواة ذرته، ويعرف هذا العدد بالعدد الذري للعنصر. فمثلاً جميع الذرات التي تمتلك 6 بروتونات في أنويتها هي ذرات عنصر الكربون، وجميع الذارت التي تمتلك 92 بروتوناً في أنويتها هي ذرات عنصر اليورانيوم. وهنالك 94 عنصراً متوفراً في الطبيعة بالإضافة إلى 18 عنصراً تم تصنيعها.
على الرغم من احتواء جميع ذرات العنصر الواحد على نفس عدد البروتونات فإن ليس من اللازم احتواءها على نفس عدد النيترونات، تسمى مثل هذه الذرات بالنظائر ويمكن أن يمتلك العنصر الواحد أكثر من نظير واحد.
أفضل تمثيل للعناصر الكيميائية هو الجدول الدوري والذي يرتب العناصر حسب عددها الذري، وتتشارك زمر ودورات العناصر في الجدول الدوري في بعض الخصائص أو تتبع نمطاً معيناً للخصائص، مثل قطر الذرة، والسالبية الكهربية، وغيرها.
المركب
المركب الكيميائي هو مادة تتكون من نسبة معينة من العناصر وتحدد تركيب المركب والمجموعة التي يقع فيها هذا المركب والتي تحدد بالتالى خواص هذا المركب. فمثلاً الماء هو مركب يحتوى على الهيدروجين الأكسجين بنسبة 2 إلى 1، حيث تكون ذرة الأكسجين محاطة بزوج من ذرات الهيدروجين وبزاوية قياسها 104.5 درجة. تتكون المركبات وتتحول عن طريق التفاعلات الكيميائية.
المادة
المادة الكيميائية هي نوع من المادة له تركيب معلوم ومجموعة من الخواص.[22] ولكن وبشكل دقيق لا يعد مزيج من المركبات أو العناصر أو المركبات والعناصر مادة كيميائية. تعد الكثير من المواد التي نراها في حياتنا اليومية نوعاً من أنواع الأمزجة، مثل: الهواء، السبائك، والكتل الحيوية.
الجزيئة
الجزيئة هي أصغر جزء غير قابل للتقسيم من المادة الكيميائية النقية، والتي تمتلك مجموعة فريدة من الخواص التابعة لها، بمعنى قدرتها إحداث مجموعة معينة من التفاعلات مع المواد الأخرى. يمكن أن تتواجد الجزيئات على شكل وحدات متعادلة كهربائياً على عكس الأيونات. تعد الجزيئات مجموعة من الذرات المرتبطة مع بعضها بروابط تساهمية، ومثل هذه البنى متعادل كهربائياً وتكون جميع الأغلفة التكافؤية متزاوجة مع الكترونات أخرى بواسطة الأواصر أو الأزواج الوحيدة.
لا تحتوي جميع المواد على جزيئات مجردة، فغالبية العناصر الكيميائية مكونة من ذرات وحيدة تمثل الوحدة المجردة الصغرى. وتنتظم الأنواع الأخرى من المواد مثل المركبات الأيونية والشبكات الصلبة بطريقة تقلل من وجود جزيئة يمكن التعرف عليها. وتدرس هذه المواد بالاعتماد على وحدات الصيغة أو البناء البلوري كأصغر وحدة متكررة بنيوية ضمن المادة، وذلك لعدم وجود جزيئات يمكن التعرف عليها.

المول وكمية المادة
المول وحدة لقياس كمية المادة، وهو عبارة عن كمية المادة التي تحتوي على (ذرات أو جزيئات أو أيونات) بقدر ما يحتويه 0.012 كلغم (12 غرام) من كربون-12، عندما تكون ذرات الكربون غير مرتبطة ومستقرة في الحالة القاعية[23]
الشوارد (الأيونات) والأملاح
الشاردة هو مركب مشحون, أو هو ذرة أو جزيئ اكتسب أو فقد إكتروناً أو أكثر. الأيونات الموجبة الشحنة تسمى شرجبة (كاتيونات) مثل كاتيون الصوديوم NaNa+ والأيونات السالبة الشحنة تسمى شرسبة (أنيون) مثل شرسبة (أنيون) الكلور Cl-, واللذان عن إتحادهما يكونا الملح المتعادل كلوريد الصوديوم(NaCl). ومثل للأيونات ذات الذرات العديدة التي لا تتفكك خلال تفاعلات الحمض - القاعدة هو مجموعة الهيدروكسيد (OH-), أو الفوسفات).
تعرف الأيونات في الحالة الغازية بالبلازما.
الحامضية والقاعدية
غالباً ما تصنف المادة كحامض وقاعدة (قلوي). وهناك نظريات متعددة شرحت السلوك الحامضي-القاعدي، أبسط هذه النظريات هي نظرية أرينوس، والتي تنص على أن الحامض هو المادة التي تنتج أيونات الهيدرونيوم عند إذابتها في الماء، وأن القاعدة هي المادة التي تنتج أيون الهيدروكسايد عند إذابتها في الماء.
أما نظرية برونشتد-لوري للحامضية والقاعدية، فتعد الحامض المادة التي تمنح أيون الهيدروجين موجب الشحنة إلى مادة أخرى ضمن تفاعل كيميائي، وبالتالي تكون القاعدة هي المادة التي تستقبل أيون الهيدروجين.
أما نظرية لويس فتعتمد على عملية تكوين أواصر كيميائية جديدة، فالحامض هو المادة القادرة على تقبل مزدوج إلكتروني من مادة أخرى أثناء عملية تكوين الأواصر، والقاعدة هي المادة التي تستطيع توفير مزدوج إلكتروني لتكوين آصرة جديدة.
الطور
بالإضافة إلى الخواص الكيميائية المعينة التي تتصف بها المواد الكيميائية فإن الأخير تتواجد أيضاً بأطوار متعددة. وعلى الأغلب فإن تصنيف المواد الكيميائية لا يرتبط بهذه تصنيف الأطوار، مع إمكانية عدم توافق بعض الأطوار مع بعض الخواص الكيميائية.
يعرف الطور بأنه مجموعة من الحالات للنظام الكيميائي والتي تمتلك نفس الخواص البنيوية، في مدى معين من الظروف، مثل الضغط ودرجة الحرارة. تميل بعض الخواص الفيزيائية مثل الكثافة ومعامل الانكسار إلى كونها خواص مميزة للطور.
الأكسدة والاختزال
مفهوم يرتبط بقابلية ذرات المواد المختلفة على اكتساب وفقدان الإلكترونات. حيث تدعى المواد القادرة على أكسدة المواد الأخرى بالمؤكسدات وتعرف بالعوامل المؤكسدة. يقوم العامل المؤكسد بإزالة الإلكترونات من المواد الأخرى. وتدعى المواد القادرة على اختزال المواد الأخرى بالمواد المختزلة أو العامل المختزل. يقوم العامل المختزل بنقل الإلكترونات إلى المواد الأخرى، وبالتالي تحصل في العامل المختزل عملية الأكسدة، ويسمى العامل المختزل كذلك بمانح الإلكترون لقيامه بهذه الوظيفة. ترمز عملية الأكسدة والاختزال إلى التغير في عدد التأكسد، وقد لا يحدث الانتقال الفعلي للاكترونات، لذا فمن المفضل أن نعرف الأكسدة بأنها العملية التي تقوم بزيادة عدد التأكسد، والاختزال بأنه العملية التي تقلل عدد التأكسد.
الروابط الكيميائية
الرابطة الكيميائية هي القوة التي تربط الذرات في الجزيء أو في البلورة. في مركبات بسيطة عديدة, نظرية التكافؤ ومبدأ عدد التأكسد يمكن استخدامهما للتنبؤ بالتركيب الجزيئي. وبالمثل, فإن النظريات الفيزياء الكلاسيكية يمكن استخدامها للتنبؤ بتركيب مركبات أيونية عديدة. أما المركبات ذات التركيب المعقد، مثل السبائك المعدنية، فإن نظرية التكافؤ لا تستطيع تفسير تركيبها, وهنا تظهر أهمية استخدام نظريات الميكانيكا الكمية مثل نظرية المدار الجزيئي.
بعض أنواع الروابط الكيميائية:
- رابطة أيونية
- رابطة تساهمية
- رابطة فلزية
ورابطة تناسقية والرابطة التناسقية تنساق تحت الرابطة التساهمية تقريبا وتوجد رابطة أخرى وهي الرابطة الهيدروجينية وتتكون عن طريق اتحاد جزيئين بحيث يكون بكل جزئ ذرة هيدروجين وذرة أخرى ذات سالبيه كهربيه عاليه والذي يؤدى إلى وقوع ذرة الهيدروجين بين ذرتين ذات سالبيه كهربيه عاليه عند الاتحاد.
الرابطة الأيونية : تتكون غالباً بين الفلزات واللافلزات حيث تكون :
الفلزات : ذراتها حجمها كبير - جهد تأينها صغير (فيسهل فقد الكترونات المستوى الأخير) فيتكون أيون موجب ليصل لأقرب غاز خامل.
اللافلزات : صغيرة الحجم - ميلها الإلكتروني كبير (فيسهل اكتساب إلكترونات) فتصبح أيون سالب لتصل لأقرب غاز خامل (نبيل).
والربطة الأيونية هي : انجذاب كهربائي بين الأيون الموجب والسالب (وليس لها وجود مادي).
التفاعل
التفاعل الكيميائي هو تحول في التركيب الدقيق للجزيئات. ويمكن أن ينتج التفاعل الكيميائي من مهاجمة جزيئات لجزيئات أخرى لتكوين جزيئات أكبر, أو جزيئات تتفكك لتكوين جزيئين أو أكثر أقل حجما, أو إعادة ترتيب الذرات في نفس الجزيء أو خلال جزيئات أخرى. وتتضمن التفاعلات الكيميائية غالبا تكوين أو تكسير روابط كيميائية.
التوازن
على الرغم من انتشار مفهوم التوازن بشكل واسع في العلوم، إلا أنه يظهر في أدبيات الكيمياء كلما توفر عدد من الحالات المختلفة في التركيب الكيميائي. على سبي المثال، في خليط من مركبات كيميائية مختلفة يمكنها التفاعل مع بعضها، أو مادة بمقدورها التواجد بأكثر من حالة. لا يعد نظام من المواد الكيميائية في حالة التوازن - على الرغم من امتلاكه لتركيب غير متغير - ثابتاً، لأن الجزيئات في حالة تفاعل مستمر مع بعضهاالبعض، وهذا يؤدي إلى ظهور حالة التوازن الدينامي. لذا فإن المفهوم يصف الحالة التي تكون فيها متغيرات مثل التركيب الكيميائي ثابتة مع مرور الوقت. لا تكون المواد الكيميائية الموجودة في الأنظمة الحية في حالة توازن، وإنما هي بعيدة جداً عن حالة التوازن.
الطاقة
في السياقات الكيميائية، ترتبط الطاقة بالمادة نتيجة لبنيتها الذرية أو الجزيئية، وبما أن التحولات الكميائية مرتبطة بتحول واحد أو أكثر من هذه البنى، فإن زيادة أو نقصاناً في الطاقة تكون مرافقة لهذه العملية. يتم تبادل بعض الطاقة بين بين المحيط والمواد المتفاعلة على شكل حرارة أو ضوء، لذا تكون طاقة المواد الناتجة أكثر أو أقل من طاقة المواد المتفاعل. يكون التفاعل باعثاً للحرارة إلى المحيط، وقد يكون التفاعل ماصاً للحرارة من المحيط.
يساعد وجود مراحل طاقة معينة للمواد الكيميائية المختلة على تشخيصها بواسطة تحليل خطوط الطيف. وتستخدم أنواع مختلفة من الأطياف في المطيافية الكيميائية، مثل مطيافية الأشعة تحت الحمراء، الأمواج القصيرة، والرنين النووي المغناطيسي.
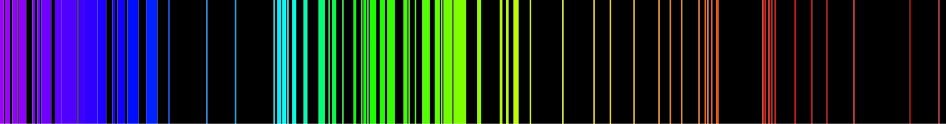
قوانين الكيمياء
تخضع التفاعلات الكيميائية لقوانين محددة، والتي أصبحت مفاهيم أساسية في الكيمياء، وهذه بعض القوانين:
- قانون أفوجادرو
- قانون بير لامبرت
- قانون شارل
- قانون فيك للانتشار
- قانون جاي لوساك
- مبدأ لو شاتيليه
- قانون هنري
- قانون هس
- قانون بقاء الطاقة الذي أدى إلى اكتشاف مفاهيم مهمة مثل التوازن والديناميكا الحرارية والحركية الكيميائية.
- قانون بقاء المادة
- قانون النسب الثابتة
- قانون النسب المتضاعفة
- قانون راؤول
نظام التسمية في الكيمياء
التسمية ترجع إلى النظام المتبع لتسمية المركبات الكيميائية. يوجد نظام معين لتسمية المواد الكيميائية. المركبات العضوية يتم تسميتها طبقا لنظام تسمية المركبات الكيميائية. المركبات غير العضوية يتم تسميتها طبقا لنظام تسمية المركبات غير العضوية. ويسمى ذلك IUPAC وهي اختصار
- تحويل قالب:إنكليزية أي الأتحاد الدولي للكيمياء النظرية والتطبيقية.
فروع الكيمياء
تقسم الكيمياء إلى عدة فروع رئيسية ومنها : تنقسم الكيمياء بصفة عامة إلى عدة فروع رئيسية، كما يوجد أيضا تفرعات لهذه الفروع, وموضوعات ذات تخصص أكبر داخل هذه الفروع.
- الكيمياء التحليلية
- هي تحليل عينات من المادة لمعرفة التركيب الكيميائى لها وكيفية بنائها.
- الكيمياء الحيوية
- هي دراسة المواد الكيميائية، والتفاعلات الكيميائية التي تحدث في الكائنات الحية.
- الكيمياء غير العضوية
- هي دراسة خواص وتفاعلات المركبات غير العضوية. ولا يوجد هناك حد واضح للتفريق بين الكيمياء العضوية وغير العضوية، كما أن هناك تداخل كبير بينهما, ويكون أهمه في فرع آخر يسمى كيمياء الفلزات العضوية.
- كيمياء عضوية
- هي دراسة تركيب، وخواص، وتفاعلات المركبات العضوية.
- الكيمياء الفيزيائية
- هي دراسة الأصل الفيزيائى للتفاعلات والأنظمة الكيميائية. ولمزيد من التحديد فإنها تدرس تغييريات حالات الطاقة في التفاعلات الكيميائية. ومن الفروع التي تهم الكيميائيين المتخصصين في الكيمياء الحرارية، الكيمياء الحركية، كيمياء الكم، الميكانيكا الإحصائية، علم الأطياف.
الصناعة الكيميائية
تمثل الصناعة الكيميائية نشاطاً اقتصادياً مهماً، حيث قدرت مبيعات أكبر 50 مصنعاً للمواد الكيميائية في العالم سنة 2004 بـ 587 مليار دولار أمريكي وبهامش ربح 8.1% ومصاريف بحث وتطوير بنسبة 2.1% من مجمل المبيعات.[24]
هيئات مختصة بالكيمياء

- المجتمع الكيميائي الأمريكي.
- المجتمع الأمريكي للكيمياء العصبية.
- المؤسسة الكندية للكيمياء.
- المجتمع الكيميائي في البيرو.
- الاتحاد الدولي للكيمياء البحتة والتطبيقية.
- المؤسسة الملكية الأسترالية للكيمياء.
- المجتمع الملكي الهولندي للكيمياء.
- المجتمع الملكي للكيمياء في بريطانيا RSC.
- مجتمع التصنيع الكيميائي.
- مصلحة الكيمياء، القاهرة.
انظر أيضا
| ابحث عن كِيمْيَاء في ويكاموس، القاموس الحر. |
- تاريخ الكيمياء
- قائمة بموضوعات الكيمياء
- قائمة أشهر الكيميائيين
- كيميائي
- تعليم كيمياء
- قائمة المركبات
- الكيمياء العربية
- خيمياء
- اكتشاف العناصر الكيميائية
- التسلسل التاريخي لاكتشاف العناصر
- الجدول الدوري
- جائزة نوبل في الكيمياء
- هندسة كيميائية
- علامات أوروبية للجودة الكيميائية
وصلات خارجية
| يوجد في ويكي مصدر كتب أو مستندات أصلية تتعلق بـ: كيمياء |
- صفحة التسمية الرئيسية, ويفضل قراءة الكتاب الذهبي الذي يحتوى على تعريفات التسميات الكيميائية الأساسية
- بيانات الأمن والسلامة لعديد من المواد الكيماوية
- بيانات الصحة والسلامة
- قاعدة بيانات الكيمياء وتتضمن بيانات أساسية ومعلومات عن السموم
- قاموس الكيمياء
- صور ومقاطع فيديو لبعض التكنيكات والتجارب
المراجع
- ↑ http://www.almaany.com/home.php?language=arabic&word=%D9%83%D9%8A%D9%85%D9%8A%D8%A7%D8%A1&cat_group=1&lang_name=%D8%B9%D8%B1%D8%A8%D9%8A&type_word=2&dspl=0
- ↑ 2٫0 2٫1 "What is Chemistry?". Chemweb.ucc.ie. Retrieved 2011-06-12.
- ↑ 3٫0 3٫1 Chemistry. (n.d.). Merriam-Webster's Medical Dictionary. Retrieved August 19, 2007.
- ↑ Is chemistry a branch of physics? a paper by Mario Bunge
- ↑ IUPAC Gold Book Definition
- ↑ تاريخ العلوم والتكنولوجيا، في العصور القديمة والوسطى ومكانة الحضارة الإسلامية فيه، د. مصطفى محمود سليمان، ص229، الطبعة الثانية، الهيئة المصرية العامة للكتاب، 2008.
- ↑ محمد بن أحمد (أبو عبد الله الخوارزمي) 387 هـ، مفاتيح العلوم، إدارة الطباعة المنيرية، القاهرة.
- ↑ عبد الحميد زايد (1966) مصر الخالدة، مقدمة في تاريخ مصر الفرعونية منذ أقدم العصور حتى 332 ق.م، دار النهضة العربية، القاهرة.
- ↑ ول ديورانت (1961)، قصة الحضارة، الجزء الثاني من المجلد الأول، الشرق الأدنى، ترجمة محمد بدران، لجنة التأليف والترجمة والنشر، القاهرة.
- ↑ ابن أبي أصيبعة، عيون الأنباء في طبقات الأطباء، مكتبة الحياة، بيروت 1965.
- ↑ حاجي خليفة، كشف الظنون في أسامي الكتب والفنون، اسطنبول، 1941.
- ↑ ابن خلدون، المقدمة، دار الكشاف، بيروت.
- ↑ تاريخ العلوم والتكنولوجيا، في العصور القديمة والوسطى ومكانة الحضارة الإسلامية فيه، د. مصطفى محمود سليمان، ص229 - 231، الطبعة الثانية، الهيئة المصرية العامة للكتاب، 2008.
- ↑ Strathern, P. (2000). Mendeleyev’s Dream – the Quest for the Elements. New York: Berkley Books.
- ↑ Boyle, Robert (1661). The Sceptical Chymist. New York: Dover Publications, Inc. (reprint). ISBN 0486428257.
- ↑ Glaser, Christopher (1663). Traite de la chymie. Paris. as found in: Kim, Mi Gyung (2003). Affinity, That Elusive Dream - A Genealogy of the Chemical Revolution. The MIT Press. ISBN 0-262-11273-6.
- ↑ Stahl, George, E. (1730). Philosophical Principles of Universal Chemistry. London.
- ↑ Dumas, J. B. (1837). 'Affinite' (lecture notes), vii, pg 4. “Statique chimique”, Paris: Academie des Sciences
- ↑ Pauling, Linus (1947). General Chemistry. Dover Publications, Inc. ISBN 0486656225.
- ↑ Chang, Raymond (1998). Chemistry, 6th Ed. New York: McGraw Hill. ISBN 0-07-115221-0.
- ↑ "General Chemistry Online - Companion Notes: Matter". Antoine.frostburg.edu. Retrieved 2011-06-12.
- ↑ Hill, J.W.; Petrucci, R.H.; McCreary, T.W.; Perry, S.S. (2005). General Chemistry (4th ed.). Upper Saddle River, NJ: Pearson Prentice Hall. p. 37.
- ↑ "Official SI Unit definitions". Bipm.org. Retrieved 2011-06-12.
- ↑ "Top 50 Chemical Producers". Chemical & Engineering News. 83 (29): 20–23. July 18, 2005.